- 欢迎来到细胞产业关键共性技术国家工程研究中心!
细胞制剂IND一体化申报服务:专业护航,快人一步

来源:细胞质量检测技术研发平台
建设单位:深圳科诺医学检验实验室
时间:2025-12-23
自2017年国家药监局(NMPA)明确细胞治疗产品按生物制品管理以来,行业进入规范化、高速发展阶段。特别是近年来“818号令”等政策持续深化,推动细胞治疗从研发走向临床的步伐显著加快。截至2025年7月,国内已有8款细胞治疗产品获批上市,IND申请累计超200项,其中仅MSCs类产品近七年的申报量已达过去十余年的十倍以上。政策清晰+审评提速+上市路径明确,共同构成了当前细胞疗法申报的“黄金窗口期”。企业若想抢占市场先机,必须高效推进IND申报与临床研究——而这正是专业一体化服务的核心价值所在。
IND申请是细胞产品走向临床的“第一道关口”,其复杂程度高、环节多、耗时久。我们凭借多年实操经验,将其梳理为清晰可执行的四大阶段,并提供全程专业支持:
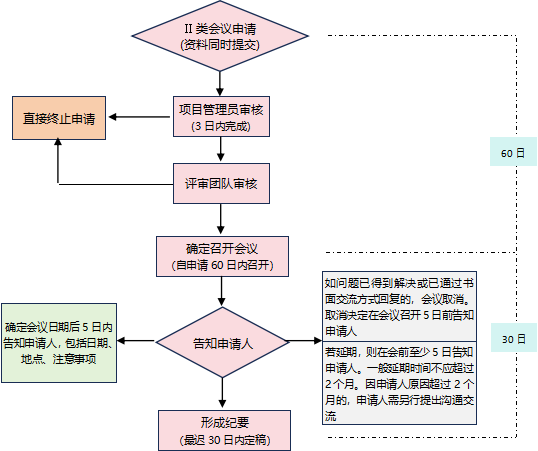
阶段一:Pre-IND沟通(约60个工作日)
我们协助您与CDE召开Ⅱ类沟通会,提前就药学策略、毒理设计等关键问题达成共识,避免后续返工。
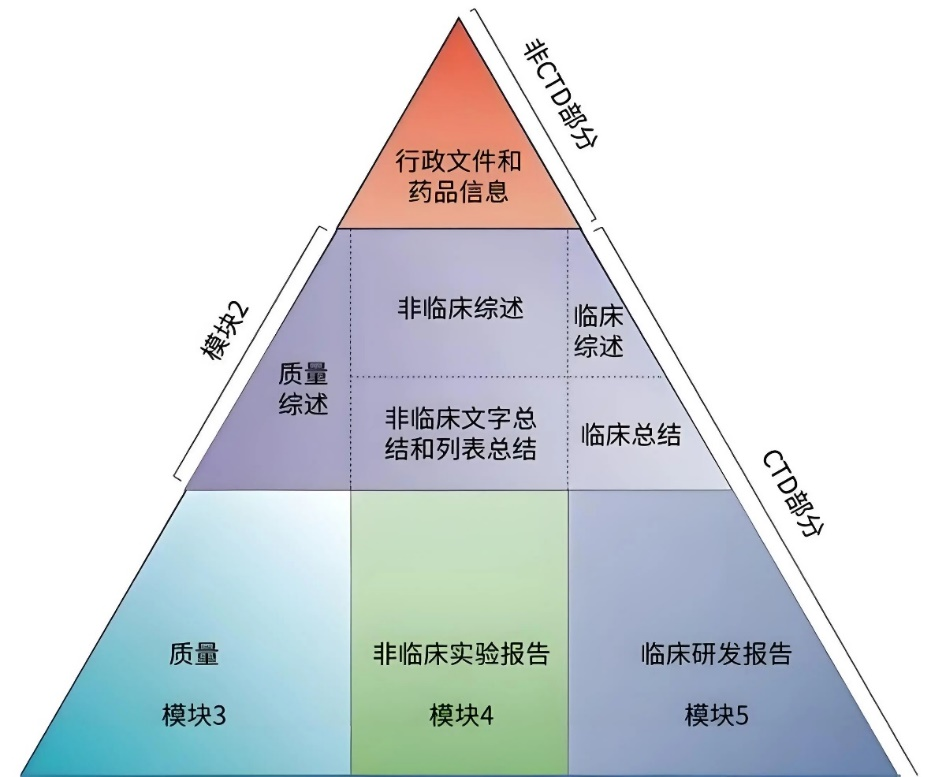
阶段二:资料撰写与提交(专业制备,杜绝形式失误)
我们提供CTD格式全程指导,包括:药学、非临床、临床三大模块资料整合文件签章、刻盘、递交流程标准化操作避免常见形式问题,提升受理效率。
阶段三:形式审查与技术审评(高效响应,进度可控)
5个工作日内完成形式审查,60个工作日内完成技术审评。我们配备专人跟踪审评进度,及时响应CDE问询,缩短补正周期。
阶段四:默示许可与临床启动(无缝衔接,快速推进)
获批后3年内需启动临床试验。我们可提供临床方案设计、中心筛选、伦理提交等后续支持,助您快速落地临床研究。
——全流程一体化服务的优势在政策驱动、行业竞争加剧的背景下,选择专业合作伙伴意味着:
1.政策精准解读:实时跟踪NMPA/CDE最新指南,预判审评趋势。
2.经验高效转化:累计参与30+细胞类IND项目,熟知常见痛点与解决方案。
3.全程一体化服务:从Pre-IND到临床启动,一个团队全程对接,避免信息断层。
4.申报周期可控:通过前置规划与预审核,平均缩短申报时间3-4个月。
5.风险主动管控:在药学、毒理、临床设计等环节提前布局,降低拒批风险。
6.资源网络支持:对接临床机构、检测平台、物流服务等生态伙伴,加速项目落地。
抢占先机,从启动对话开始2025年是细胞治疗产品IND申报的“冲刺年”。许多企业已加快布局,竞争日趋激烈。我们建议:若您处于研发后期,应尽快启动Pre-IND规划;若您已有初步数据,可同步开展资料对标与差距分析;若您希望“轻资产、快推进”,我们提供从申报到临床的全程委托服务。
细胞治疗的正规化、产业化时代已全面到来。政策在推动,市场在等待,时机在眼前。选择专业的全流程合作伙伴,不仅是为了“通过审评”,更是为了更快上市、更稳落地、更具竞争力。让我们携手,把复杂的流程交给专业,把宝贵的时间留给创新。联系我们,获取《细胞制剂IND申报全流程服务方案》及最新政策解读资料。抢占窗口期,共赢细胞未来!
立即【扫描关注/电话联系,客服热线:13682317094】,开启您的“精准可靠”研发之旅!

