- 欢迎来到细胞产业关键共性技术国家工程研究中心!
抗衰老第三站:代谢药物的抗衰奇效——二甲双胍

来源:产业创新人才培养中心
建设单位:个体化细胞治疗技术国家地方联合工程实验室(深圳)
时间:2025-03-18
二甲双胍(Metformin)是全球应用最广的双胍类降糖药,它的历史与欧洲传统草药甘露(Galega officinalis)有关,甘露被发现含有丰富的胍,在1918年被证明可以降低血糖。自法国医生Jean Sterne在1957年首次报道了使用二甲双胍治疗糖尿病。历经半个多世纪,其已成为2型糖尿病治疗的核心药物。而我们今天要讲的,是北京基因组研究所的张维绮与中国科学院动物研究所的刘光慧团队合作,在2024年发表于《Cell》的突破性研究《Metformin decelerates aging clock in male monkeys》,论文首次在恒河猴模型中证实二甲双胍可逆转表观遗传衰老时钟,为人类抗衰老应用提供了关键灵长类动物证据,不少媒体都将该文称为2024年衰老领域十大重磅进展之一。
摘要
本研究通过40个月的恒河猴实验,首次系统评估了二甲双胍在灵长类动物中的抗衰老效应。研究采用全组织转录组、DNA甲基化组、血浆蛋白质组和代谢组等多维度分析构建衰老时钟,发现二甲双胍显著延缓多个生物年龄指标,其中大脑年龄逆转约6年,并表现出神经保护作用——维持脑结构完整性、提升认知功能。机制研究表明,该效应部分通过激活抗氧化转录因子Nrf2通路实现。相较于既往小鼠模型,恒河猴在基因相似度(93%)、脑结构复杂度(特别是前额叶皮层)及自然衰老特征(动脉硬化、骨密度降低、认知衰退)方面更接近人类。其自发产生的类似人类的老年疾病为药物效果评估提供了更可靠的预测模型,尤其在神经退行性疾病研究领域具有独特优势。该研究填补了抗衰药物从啮齿类向灵长类转化研究的关键空白,为推进人类衰老干预策略奠定了重要基础。
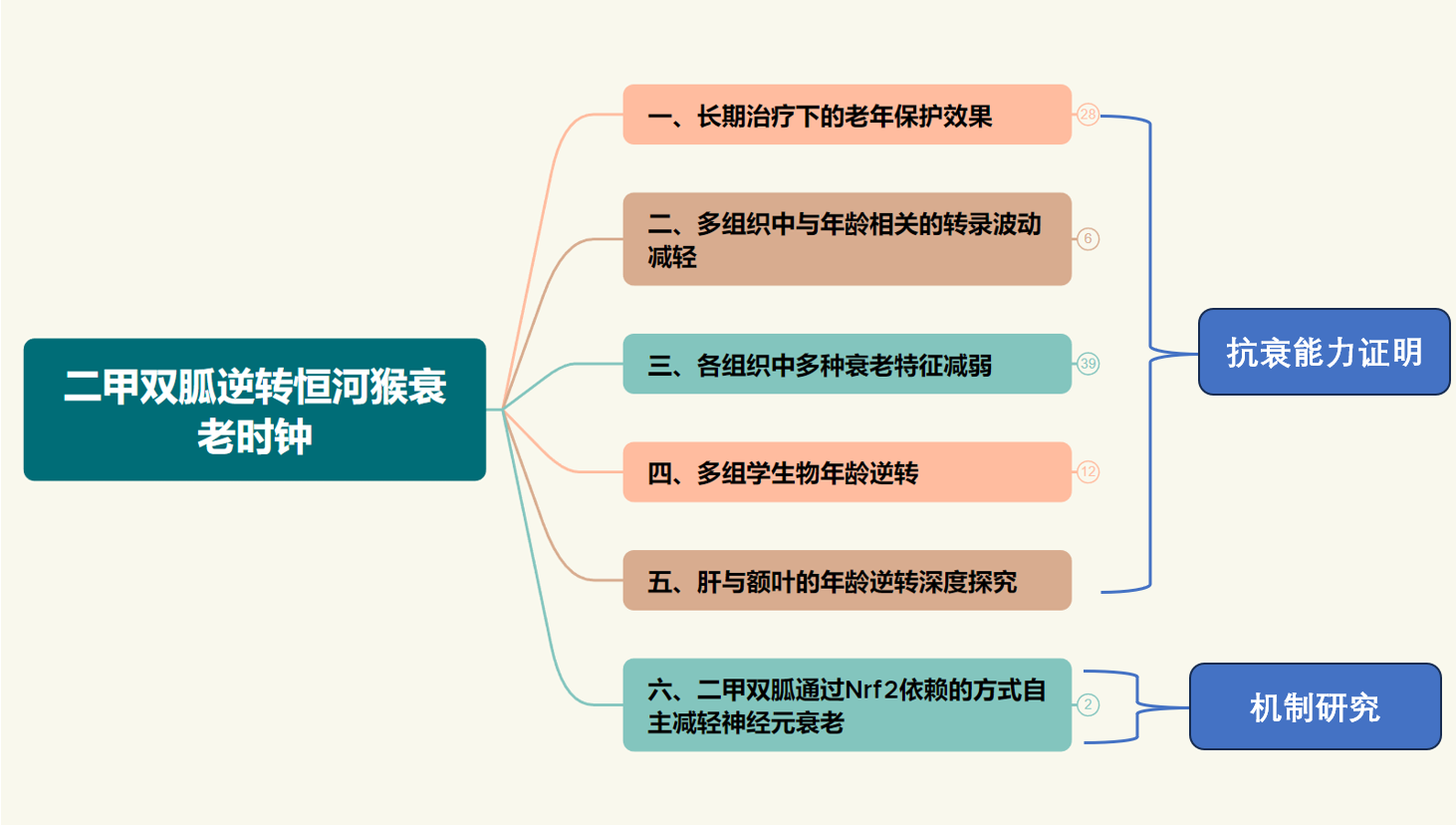
将整篇文章进行综合分析并整理,可以将文章整合成如图所示六大项,其中前五项为二甲双胍各方面抗衰能力的证明,最后一项为实现的机制研究。
整个实验共用了四组恒河猴,分别为:
①青年组(3-5岁的恒河猴,约等于人类青春期,6只。)
②中年组(10-12岁的恒河猴,约等于人类30-40岁,3只。)
③老年对照组(13-16岁的恒河猴,约等于人类40-50岁,接受等量安慰剂治疗,5只。)
④老年实验组(13-16岁的恒河猴,约等于人类40-50岁,每天接受20 mg/kg的二甲双胍剂量,人类糖尿病管理中的标准剂量,6只。)

其中③作为实验组④的主要对照组,本应该与④使用等量猴子,但遗憾的是研究的第1126天, ③中经兽医确认有一只猴子因肾衰竭而死亡,因此仅保留5只的数据。组③组④的猴子持续培养1200天,大约3.3年,相当于人类的10年左右。
长期的二甲双胍使用结果显示:血糖稳态、体重、血液细胞组成和尿液等生理特征均不会因使用二甲双胍受到影响。
1、行为学检测
为了综合评估记忆、学习和认知灵活性的变化,实验使用了威斯康辛一般测试装置(Wisconsin General Testing Apparatus, WGTA)方法。
威斯康辛一般测试装置是由心理学家Harry Harlow于20世纪30年代设计的经典实验装置,主要用于评估非人灵长类动物(如恒河猴)的认知能力。其核心任务包括延迟任务、物体辨别任务和物体逆转学习任务。
①延迟任务:将食物放在左右方块某一侧的后方,随后用遮挡物遮挡猴子视线5秒至数分钟,移除遮挡后观察猴子是否选择有食物的一侧方块。能有效评估猴子的工作记忆长度。
②物体辨别任务:将食物放在黑白某一颜色方块的后方,动物需通过多次尝试(约20-50次)学习正确选择,随后随机交换物体位置,排除空间偏好干扰,评估模式识别与联想学习能力,常用于检测阿尔茨海默病模型中物体识别记忆的退化。
③物体逆转学习任务:将食物放在黑白某一颜色方块(如白色)的后方,让猴子完成物体辨别。随后进行反转(食物改放黑色后方),记录猴子适应新规则的尝试次数与错误率。评估认知灵活性与抑制控制能力,常用于检测研究强迫症、帕金森病等执行功能障碍疾病。
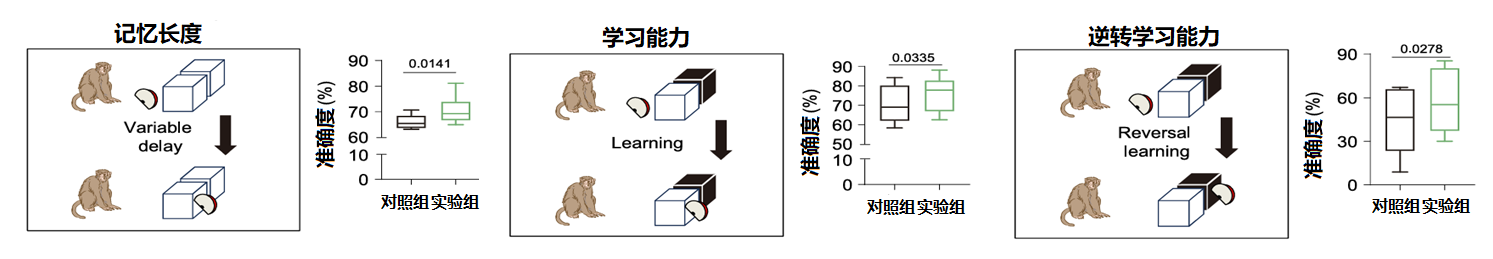
三组实验结中,使用了二甲双胍的实验组结果均优于使用安慰剂的对照组,证明二甲双胍能综合性的改善老龄动物的记忆、学习能力和认知韧性。
2、大脑皮层检测
研究人员使用磁共振成像(MRI)研究了大脑形态,以老年组为对照组,其余组别与老年组对比结果,红色代表大脑皮层增厚,蓝色代表大脑皮层减薄。
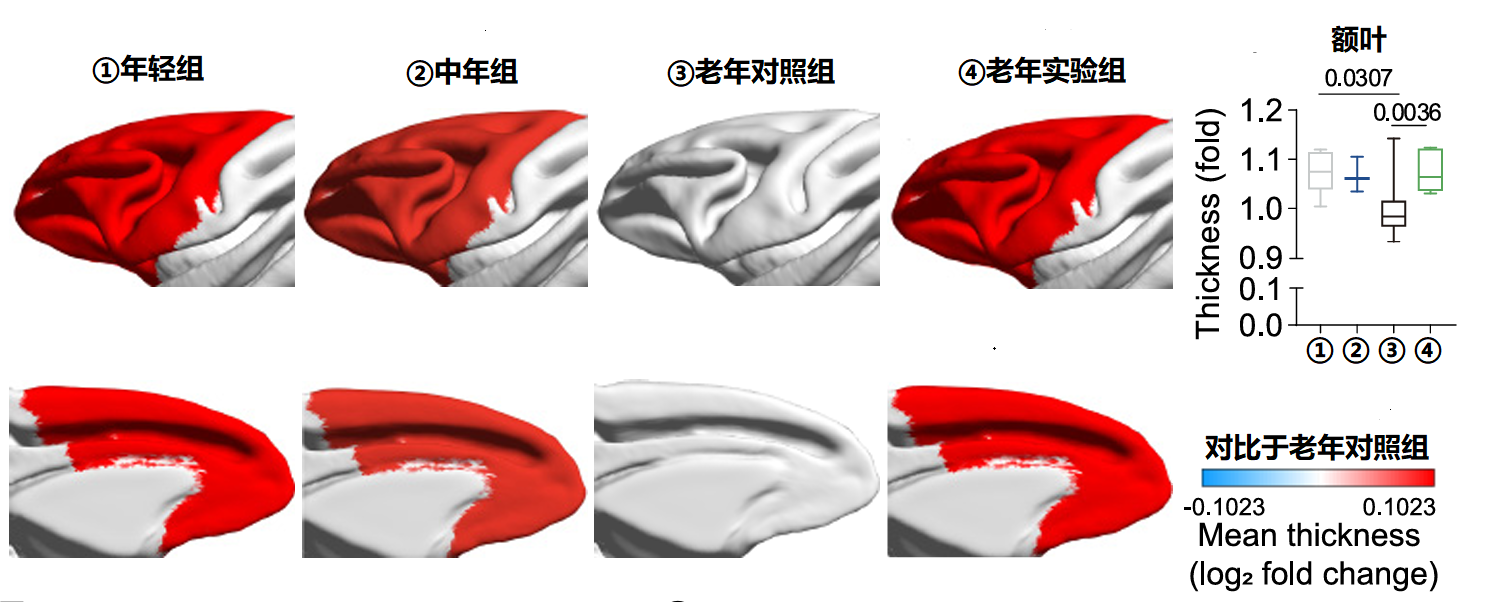
结果显示,老年猴子的大脑皮层厚度较年轻猴子显著减少,特别是在额叶和颞叶。而在接受二甲双胍治疗的老年猴子中,额叶皮层的厚度得到保留,顶叶皮层的厚度有增加的趋势。
通过使用CHARM5图谱将大脑划分区,研究人员发现二甲双胍治疗的猴子在多个区域的皮层厚度都有所恢复,包括对认知功能和运动皮层重要的9个区域。
为了从分子层面深入了解灵长类动物的衰老及其系统性效应,实验人员对四组实验猴的全身79个组织/器官进行了全面的RNA-seq分析,覆盖全身11大系统。
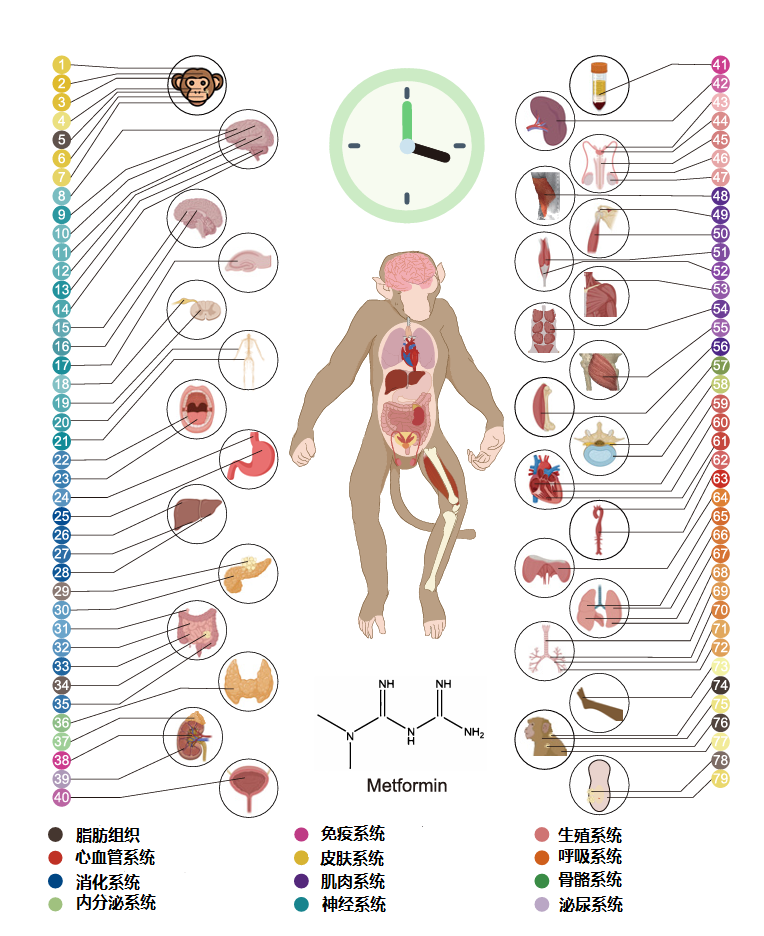
通过青年、中年和老年的试验猴基因数据进行聚类分析,研究人员成功将年龄相关的基因表达变化分为4个聚类。①随年龄上升持续上调,②随年龄上升持续下调,③随年龄上升先上调后下调,④随年龄上升先下调后上调。
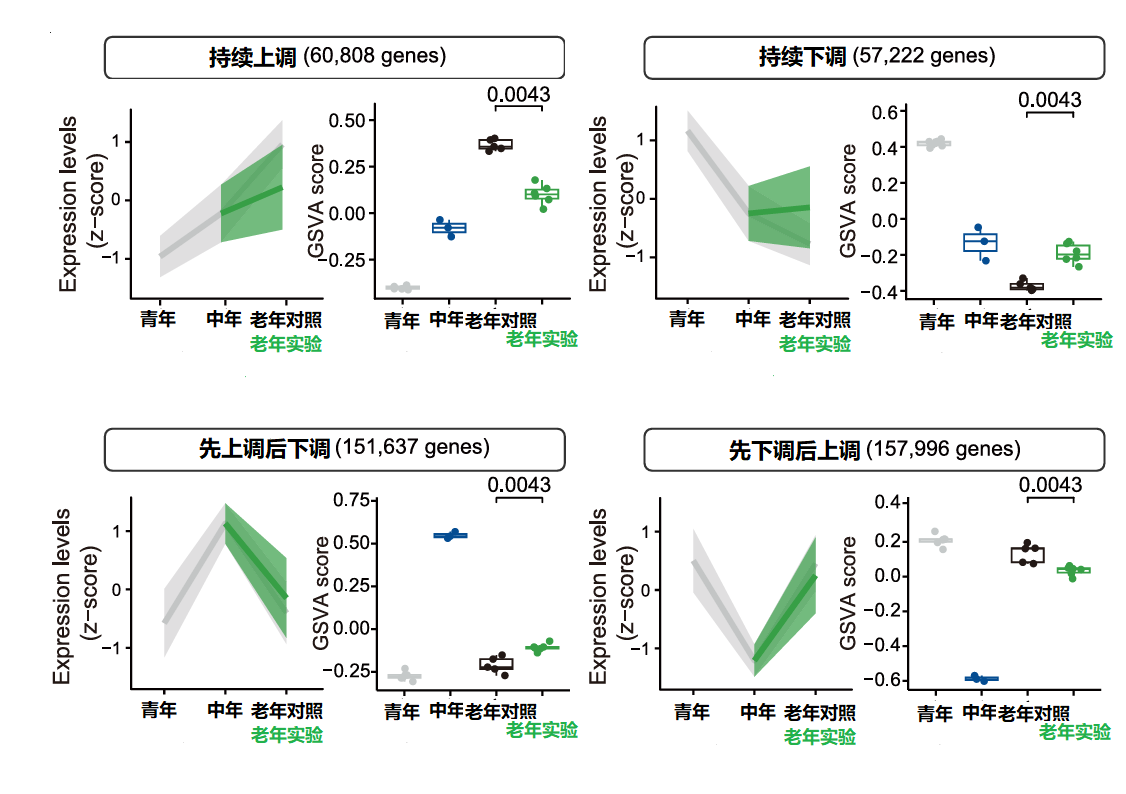
通过对比老年对照组与使用二甲双胍的老年实验组数据,研究人员发现二甲双胍显著恢复了聚类①和②中基因的表达,在其他两个聚类中的效果则不那么明显。
为了更好的量化二甲双胍减轻衰老的程度,实验人员用了一种独特的计算方法来计算每个组织的“救援分数”(rescue score)。
为了方便读者更容易理解救援分数,我这里以一组假设的数据举例,假如某个随年龄持续上调的基因在20岁表达为10,在40岁表达为20,在60岁表达为30,而使用二甲双胍后的原本60岁的个体基因表达从30变成了20,就可以认为二甲双胍将该基因的表达恢复到了40岁的水平,即逆转20岁的年龄。当然,在实际实验中这样的单个基因数据有十数万份。
通过对这些数据的整合,研究人员发现:
在组织修复中:二甲双胍修复了大多数老化组织,其中额叶、皮肤、肝脏、肾脏、股四头肌和肺等组织修复最为显著。
在细胞信号通路中:二甲双胍抑制了炎症/纤维化等衰老相关通路,同时激活Wnt信号、脂代谢等年轻态通路。
在获得“救援分数”数据后,研究人员对分数较高的组织(如肺、肝、肾、皮肤等)进行组织学分析,着重关注多种衰老标志物,包括:衰老细胞(p21阳性细胞),纤维化区域,脂质过氧化(4-HNE标记),表观遗传稳定性(H3K9me3、ERV蛋白),骨骼肌纤维类型(快肌II型纤维),炎症相关指标(免疫细胞浸润、SASP因子)。
最终结果显示:
衰老细胞减少:肺、肝、肾等组织中p21阳性细胞数量下降。
纤维化抑制:肺、肾、心脏的纤维化区域缩小。
代谢异常缓解:尿路系统脂质过氧化(4-HNE)积累减少。
表观遗传修复:衰老相关的H3K9me3丢失和ERV蛋白异常表达被逆转。
肌肉功能维持:骨骼肌中快肌II型纤维的流失得到抑制。
炎症全面缓解:肝、胃中炎症区域缩小,肺/肝/肾免疫细胞浸润减少。SASP因子(TNF-α、IL-1β等)在多个组织中表达降低。
这些结果显示二甲双胍通过减少衰老细胞积累、抑制纤维化与炎症、修复表观遗传异常等多重机制,系统性缓解灵长类动物组织衰老。
为了量化二甲双胍引起的生物年龄减缓,实验人员基于多组学数据建立了猴子衰老时钟的计算模型。指标包含:DNAmAge(基于DNA甲基化)、transcriptAge(基于转录组)、proteinAge(基于蛋白质组)和metabAge(基于代谢组)。
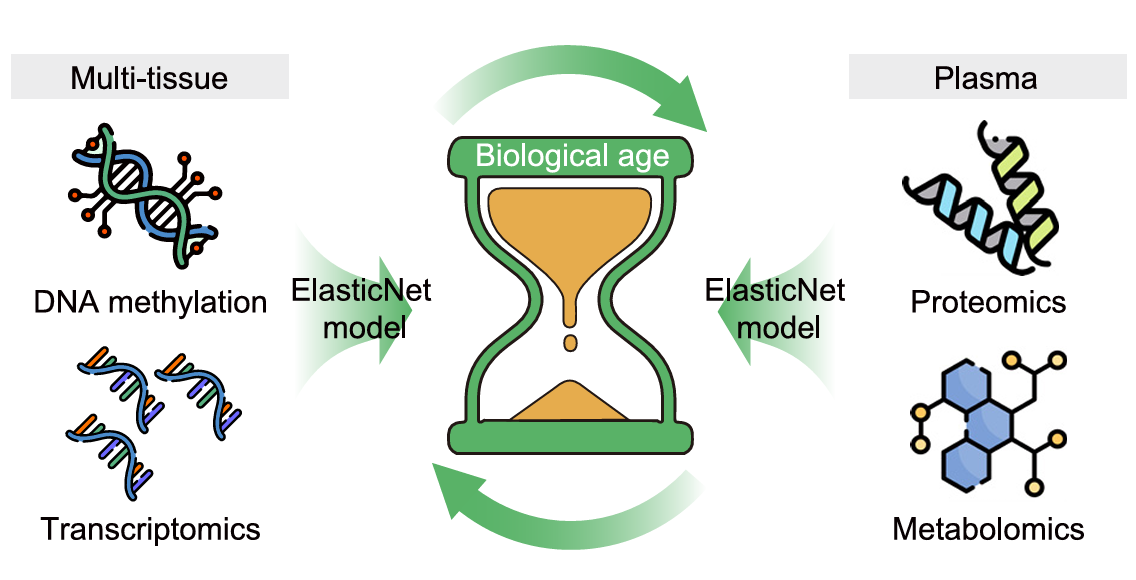
虽然看上去十分复杂,但实际理解起来却与前文相似,通过青年、中年和老年的多组学数据整合为一个线性模型,便得到了文章开篇提到的猴子衰老时钟。再将二甲双胍实验组的数据代入这个模型,就能判断出二甲双胍对该组织/器官状态逆转年限。
最终的年龄逆转数据如下:
蛋白质组年龄:平均逆转6.41年。
DNA甲基化年龄:多组织DNA逆转效果也显著,例如额叶(-6.10年)、肺(-5.11年)、肾皮质(-4.90年)、肝(-3.95年)。
转录组年龄:13个组织转录年龄均逆转,尤以跟腱(-5.31年)、肝脏(-4.14年)、支气管(-3.71年)效果最显著。
代谢组年龄:平均逆转2.30年。
总体来看,二甲双胍干预在多种组织和不同的组学层面上延缓了衰老。
由于肝与额叶在前文中显示出显著的年龄逆转,作者对这两个器官/组织进行了更深入的研究,也就是对器官/组织内各种类型的细胞进行单核RNA测序(snRNA-seq),获得“单核转录组衰老时钟”,以达到在细胞类型水平上表征衰老及其减缓的效果。
1、肝脏年龄逆转结果
对比肝脏的年龄逆转状况,肝脏中有三种细胞表现出明显的恢复到更年轻状态的效果,分别为肝细胞(-5.83年)、库普弗细胞(-6.66年)和T细胞(-6.43年)。
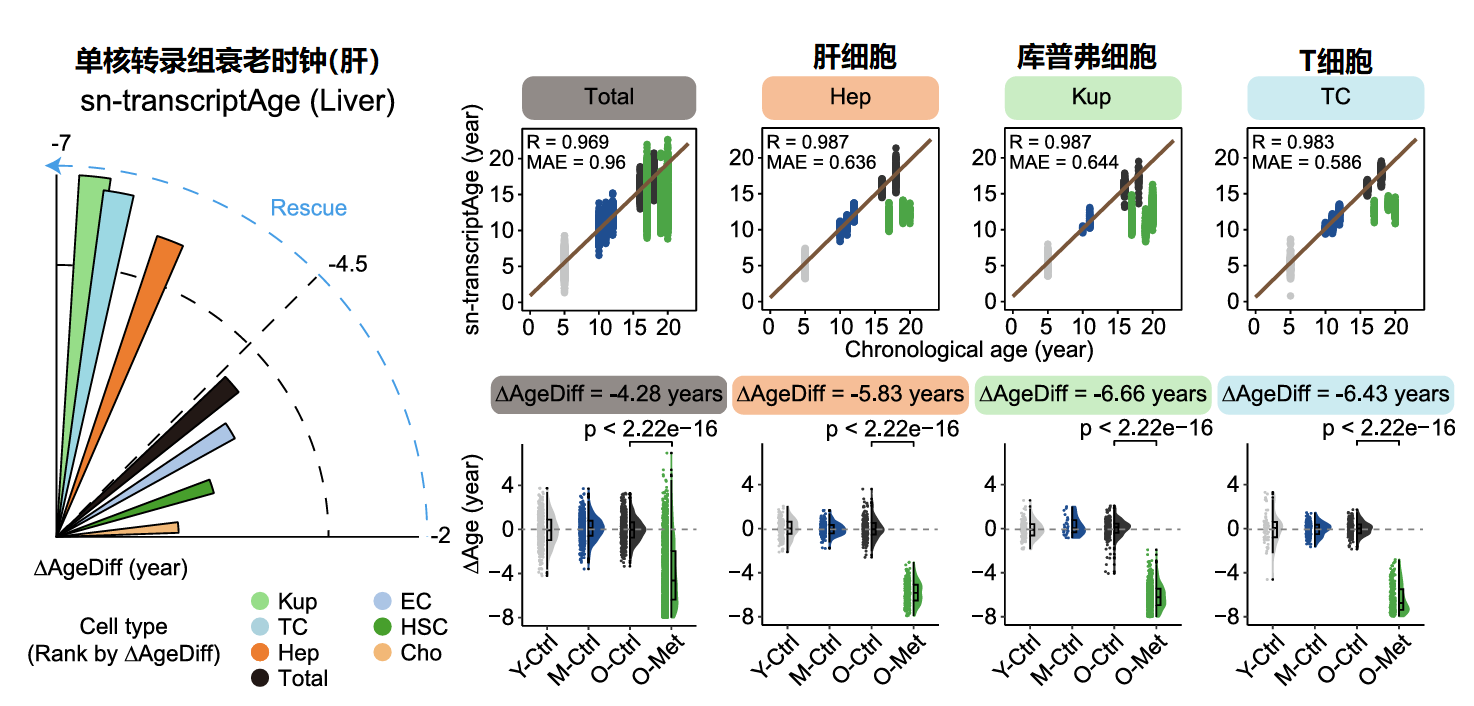
肝脏各细胞中年龄相关的基因表达变化中,持续上调的基因聚类被二甲双胍恢复33.9%,它们与免疫反应和转化生长因子-β(TGF-β)通路以及炎症反应相关。而持续下调的基因聚类被二甲双胍恢复21.2%,它们与脂质运输和脂质分解代谢以及氨基酸分解代谢相关。
这些结果表明,二甲双胍通过增强肝细胞的代谢功能,保护了肝脏功能。
2、额叶年龄逆转结果
通过整合所有额叶细胞类型的数据,二甲双胍治疗使猴子的额叶平均年轻5.90年。其中明显的恢复到更年轻状态的效果有小胶质细胞(-6.86年)、少突胶质细胞(-6.79年)、星形胶质细胞(-6.08年)和少突胶质前体细胞(-5.70年)。
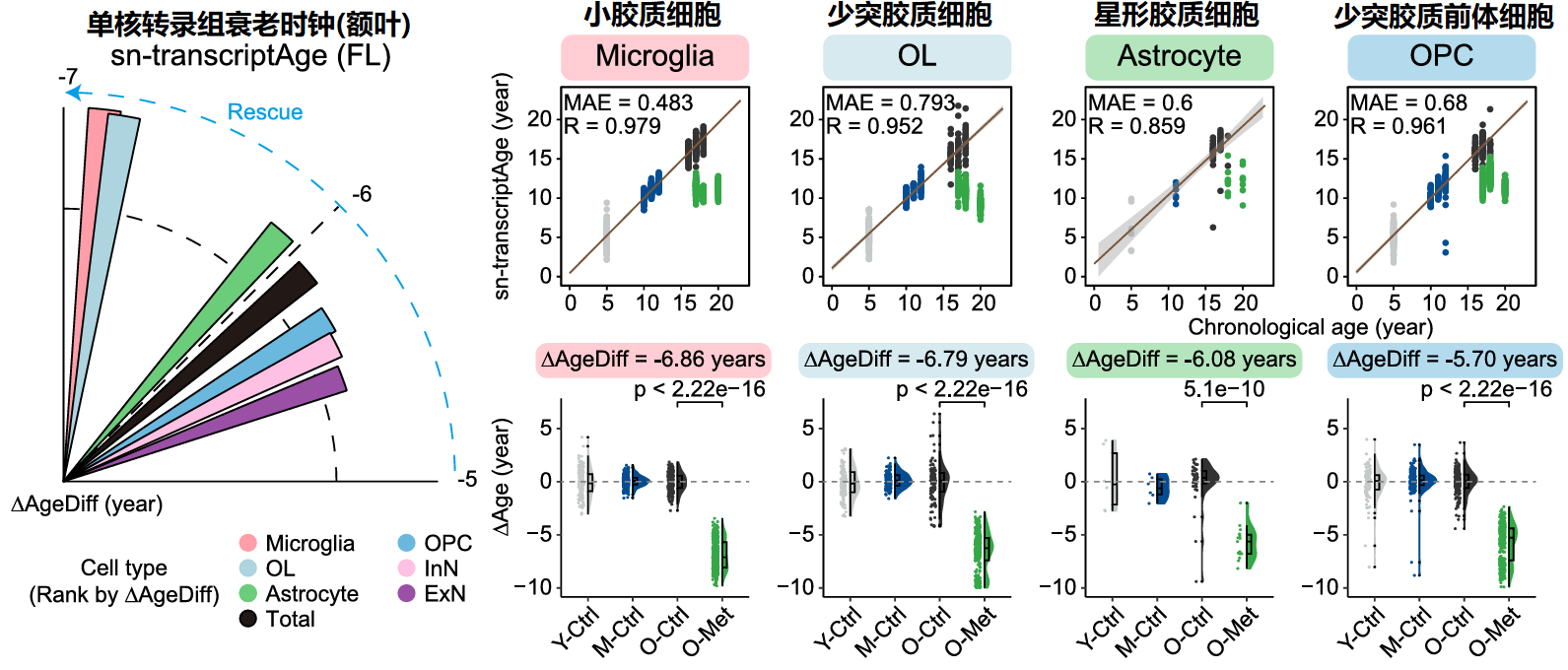
额叶各细胞中年龄相关的基因表达变化中,持续上调的基因聚类被二甲双胍恢复30.1%,它们与免疫反应激活、补体通路及TGF-β受体信号通路调控相关。而持续下调的基因聚类被二甲双胍恢复28.0%,主要是调控神经元功能的关键基因。
这些结果表明,二甲双胍通过以下多维度作用实现额叶神经保护:代谢与炎症调控、神经元结构修复、神经再生促进和通路再平衡。
在最后的机制研究中研究人员用实验室培养的人类神经元做测试,发现低剂量二甲双胍连续使用15天后,神经元的衰老指标(如衰老相关酶活性、有害蛋白堆积、炎症因子等)明显减少,同时观察到细胞核内被激活的Nrf2蛋白增多,并带动其下游抗氧化基因(如HO-1、SOD3等)表达增强,有效降低了神经元内的氧化损伤物质和活性氧水平。
为了验证Nrf2的关键作用,实验人员通过基因手段抑制Nrf2和增强了Nrf2活性,结果显示:
抑制Nrf2活性时:二甲双胍的保护效果消失,神经元加速衰老;
增强Nrf2活性(通过基因突变阻止其被降解)时,神经元即便不用药也能显著延缓衰老,且效果优于单独使用二甲双胍。
这些体外实验结果在猴子的脑部神经元中也得到验证,证实二甲双胍主要通过激活Nrf2通路帮助神经元抵抗衰老,为理解其延缓大脑衰老的机制提供了重要依据。
该研究填补了二甲双胍在灵长类衰老机制中的关键空白。针对样本量(n=21)的潜在争议,需考虑灵长类实验的高昂成本(单只饲养费为小鼠500倍)及伦理限制。选择雄性恒河猴既可规避雌性代谢周期干扰,也与二甲双胍调节睾酮水平影响衰老的机制相契合。尽管其整体作用机制(如肠道菌群互作、组织特异性效应等)仍需探索,但研究首次揭示二甲双胍通过激活Nrf2通路逆转脑衰老表型,为代谢干预神经退行性疾病建立分子关联,并为靶向抗氧化系统开发抗衰疗法提供了理论基石,推动后续精准化临床研究。
参 考 文 献
[1] Yang, Y., Lu, X., Liu, N., et al. (2024). Metformin decelerates aging clock in male monkeys. Cell 187(22), 6358-6378.e29.
https://doi.org/10.1016/j.cell.2024.08.021
[2] Bailey, C.J. (2017). Metformin: historical overview. Diabetologia 60(9), 1566-1576.
https://doi.org/10.1007/s00125-017-4318-z
[3] SterneJ(1957)Du nouveau dans les antidiabétiques.La NN dimethylamine guanyl guanidine (N.N.D.G.) Maroc Med 36:1295–1296 [article in French]
[4] Fernández-García,J.C.,Barrios-Rodríguez,R., Asenjo-Plaza, M., et al. (2022). Metformin, testosterone, or both in men with obesity and low testosterone: A double-blind, parallel-group, randomized controlled trial. Metabolism 136, 155290.
https://doi.org/10.1016/j.metabol.2022.155290
