- 欢迎来到细胞产业关键共性技术国家工程研究中心!
《中国生物经济发展报告2023》节选之①——细胞与基因治疗的行业概览

来源:产业创新人才培养中心
建设单位:个体化细胞治疗技术国家地方联合工程实验室(深圳)
时间:2023-06-29

行业概览
2022年是细胞与基因治疗(cell & gene therapy,CGT)行业发展里程碑的年份。临床研究法规制定及对患者的影响评估等方面取得稳步进展。
CAR-T(chimeric antigen receptor T-cell)治疗:对于基因治疗药物在罕见病方面的研究进展,2022年可以说是创下纪录的一年。美国FDA批复了2个CAR-T产品用于血液肿瘤的早期治疗。至此,美国和欧盟累计批复了6个CAR-T产品上市,也开始将其用于适应证的二线治疗。
CRISPR(clustered regularly interspaced short palindromic repeats)产品:2022年距发现CRISPR已有10年。美国FDA可能会在接下来不到一年的时间里批复一个CRISPR产品上市,治疗一种被忽略的罕见病——镰状细胞贫血,其也是目前再生医学能针对性发挥作用的单基因病。2022年6月,有一些新的基因编辑技术,如碱基编辑首次进入临床,用于治疗家族性高胆固醇血症,其是诱发心脏病的一个常见原因。
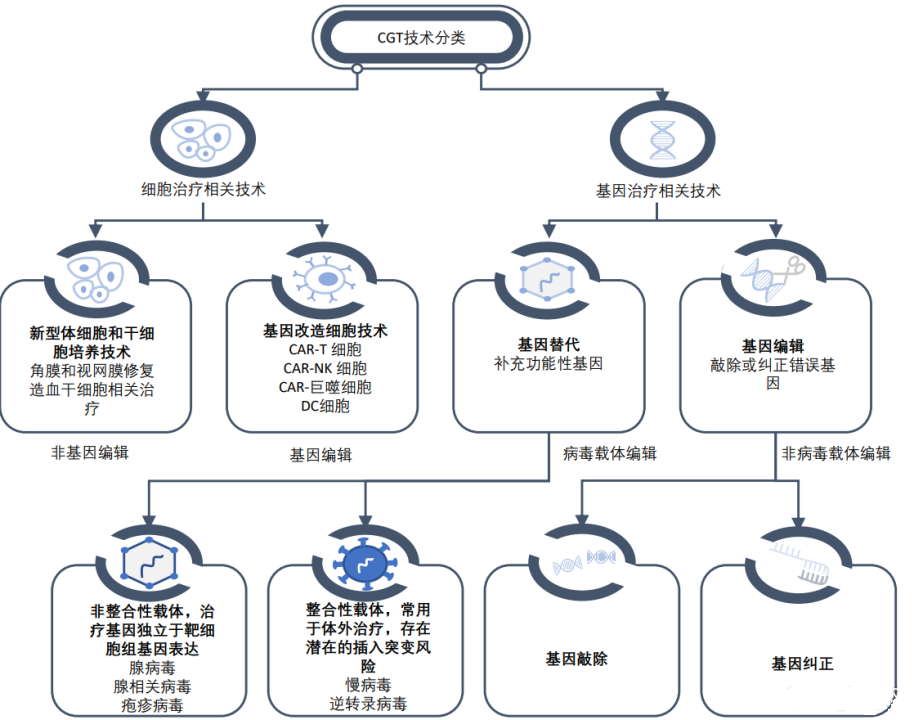
从业企业概览:2022年全球以CGT为主营业务的公司有1457家,相较2021年增加了11%。主要区域分布如下,北美地区686家,欧洲地区244家,亚太地区492家,其他地区35家。
行业投融资概况:2022年的投融资情况相对前2年回归理性,面对总体宏观经济逆势,CGT 行业保持着发展韧性,总计投融资金额为126亿美金。生物科技行业的股票市场表现有所下降,对早期阶段的小型细胞和基因治疗公司的影响尤为突出,也因此,通货膨胀环境和预期对CGT行业的发展不算友好。从国际市场总体情况来看,IPO在2021年创下纪录后几乎枯竭。也因此,风险投资成了2022年最大的单一投资来源,虽然相较2021年的峰值略有回落,但仍显示出较强的发展动力,显示出市场对科学突破,以及改变罕见病与流行病治疗范式的潜力抱有预期。
主要临床研究:2022年全球总计有2220项注册临床研究在进行中,其中43%临床研究项目在北美地区开展,38%在亚太地区,18%在欧盟地区;其中202项为Ⅲ期临床试验。所有开展的临床研究项目中,有超过100项的临床研究为基因编辑治疗。2022年当年新增的临床研究项目有254项,其中48%来源于亚太地区。58%的临床研究项目针对的适应证为常见病;60%聚焦肿瘤治疗,实体瘤和血液肿瘤呈现均分。
截至2022年12月31日,我国国内共有57款干细胞药物临床试验申请获得国家药品监督管理局药品审批中心(CDE)受理,其中43款获得临床试验默示许可,已经进入或即将进入临床试验阶段。共有106款免疫细胞药物临床试验申请获得CDE受理,其中39款获得临床试验默示许可,已经进入或即将进入临床试验阶段。
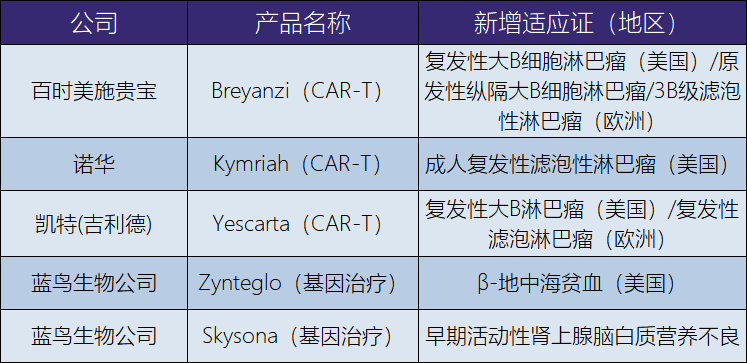
对于CGT行业的发展,2022年是创造了更多“第一”的一年。在罕见病方面,2022年是创纪录的一年(表12-86)。2022年7月,欧盟批复了第一个治疗罕见病芳香族L-氨基酸脱羧酶缺乏症的基因治疗药上市。2022年8月,欧盟再次批复了第一个治疗甲型血友病的基因治疗产品上市。下半年有2个基因治疗产品获批上市,一是乙型血友病的基因治疗产品同时在美国和欧盟获批上市,另一个是治疗早期活动性肾上腺脑白质营养不良的基因治疗产品在美国获批。这是以往从未发生过的监管情形,一年内批复超过1个治疗罕见病的新型基因治疗产品上市。还有一个值得关注的消息是,蓝鸟生物公司治疗β-地中海贫血的基因治疗产品于2019年在欧盟上市后,在2022年也获批进入美国市场(表12-87)。
表12-86 2022年新获批上市的基因治疗产品
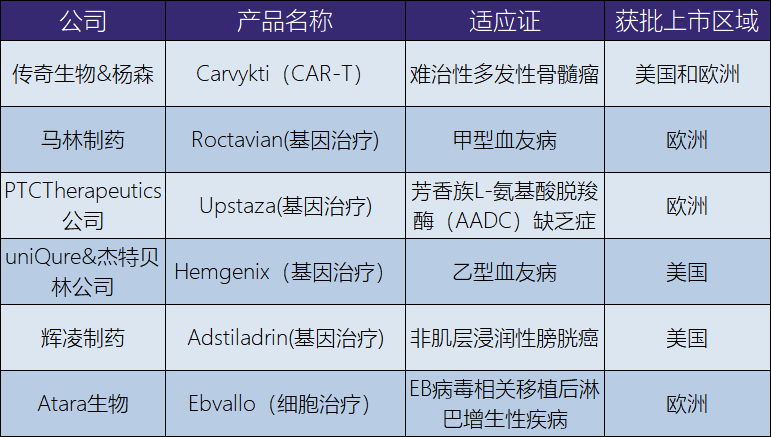
表12-87 已上市产品2022年新增获批区域/新增适应证
美国FDA有望在2023年批复至少5个治疗罕见病的基因治疗药物上市,并且第一个CRISPR药物有望在2023年获批上市;第一个治疗实体瘤的细胞治疗产品将于2023年获批上市;第一个异基因通用型T细胞治疗将于2023年在美国上市;第一个治疗进行性假肥大性肌营养不良的药物也有望于2023年上市。2023年,中国也有望批复3个本土研发的CAR-T产品在中国境内上市。

